2024年5月21日,國家藥監局藥品審評中心(CDE)官網公示,恒瑞醫藥自主研發的靶向TROP-2抗體偶聯藥物(ADC)注射用SHR-A1921擬納入突破性治療品種。此次擬定的適應症爲:用于治療鉑耐藥複發上皮性卵巢癌、輸卵管癌或原發性腹膜癌患者。
此前,2024年3月28日,注射用SHR-A1921的新適應症獲得美國食品和藥物監督管理局(FDA)授予快速通道資格(FTD),用于治療鉑耐藥複發上皮性卵巢癌、輸卵管癌及原發性腹膜癌患者。
TROP-2在各種人類上皮癌中高度表達,包括乳腺癌、肺癌、胃癌、結腸直腸癌、胰腺癌、前列腺癌、宮頸癌、頭頸癌和卵巢癌等。TROP-2的過表達在腫瘤生長過程中起著關鍵作用。約90%的上皮性卵巢癌患者表達TROP-2,約60%的患者過表達TROP-2。因此,針對TROP-2的藥物開發將爲治療卵巢癌提供新的選擇。
注射用SHR-A1921是恒瑞醫藥自主研發的一款靶向TROP-2的ADC藥物。其可與表達TROP-2的腫瘤細胞特異性結合,經腫瘤細胞內吞後在溶酶體內水解釋放小分子毒素,從而誘導腫瘤細胞凋亡。此外,該産品還具有明顯的旁觀者效應,可對靶細胞旁的TROP-2表達陰性的腫瘤細胞進行有效殺傷。

代號:SHR-A1921
靶點:TROP-2
廠家:恒瑞醫藥
美國首次獲批:尚未獲批
中國首次獲批:尚未獲批
臨床數據
在2023年AACR 會議上,恒瑞醫藥披露了ADC藥物SHR-A1921治療晚期實體瘤患者的I期首次人體研究結果。
在這項多中心、開放標簽的I期臨床試驗中,旨在評估SHR-A1921在晚期實體瘤患者中的安全性、耐受性、PK和抗腫瘤活性。研究包括:劑量遞增、劑量擴展和療效拓展3個階段。研究的主要目的是評估SHR-A1921的安全性和耐受性,並確定最大耐受劑量(MTD)和/或推薦的II期劑量。
截至2022年10月21日,共納入了38例標准治療失敗的晚期實體瘤患者。44.7%的患者既往接受過≥3線系統性抗腫瘤治療;其中,71.1%(27/38)爲驅動基因陰性的非小細胞肺癌(NSCLC)患者,既往接受過鉑類化療和抗PD-(L)1抗體。
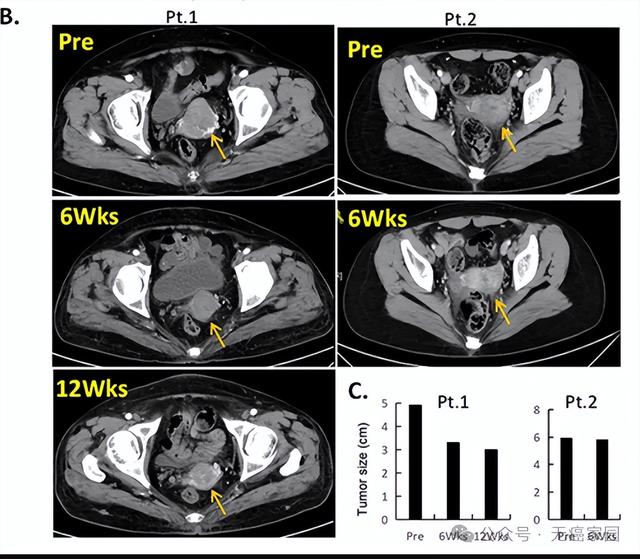
數據截止時,10例患者(NSCLC,n=5;三陰性乳腺癌,n=2;壺腹癌,n=2;卵巢癌,n=1)達到部分緩解(PR):4例確診,6例需進一步確診。客觀緩解率爲33.3%(10/30;95%,置信區間:17.3~52.8),疾病控制率爲80.0%(24/30;95%,置信區間:61.4~92.3)。
不良反應
4例患者報告了劑量限制性毒性,均爲3級口腔炎。確定的最大耐受劑量(MTD)爲4.0 mg/kg。
在所有劑量組中,最常見的治療相關不良事件(TRAEs;≥30%)爲惡心(71.1%)、口腔炎(65.8%)、貧血(42.1%)、嘔吐(36.8%)、食欲下降(36.8%)、體重下降(36.8%)和皮疹(36.8%)。≥3級TRAE發生12例(31.6%);其中,最常見的是口腔炎(n=7, 18.4%),所有其他事件均在≤2例患者中報告。沒有患者因TRAEs而中斷研究治療。
小結
總的來說,SHR-A1921在既往接受過治療的晚期癌症患者中顯示出可控的安全性和有希望的抗腫瘤活性。
參考來源:
https://www.cde.org.cn
https://aacrjournals.org
【重要提示】所有文章信息僅供參考,具體治療謹遵醫囑!