研究背景
生物分子凝聚物 (biomolecular condensate) 是具有諸多生物功能的無膜細胞器,如細胞器形成、信號傳導、基因轉錄和蛋白翻譯。這些結構被定義爲“生物分子凝聚體”,它們的形成受到體內組織、器官和生理環境的影響。然而,相分離失調時會導致病理性凝聚物的形成,從而會導致腫瘤疾病和神經性等疾病。
雖然已經確認了許多蛋白質具有相分離的能力並且能夠形成生物分子凝聚物,但在內源水平上,對于哪些蛋白質可以在生理條件下發生相分離,以及它們在這一過程中與何種夥伴相互作用仍然存在許多問題。
因此,科學家們迫切需要一種高通量的蛋白質組學方法,以識別在某些生理事件中發生相分離或分配到凝聚物中的內源性蛋白質。然而,由于這些結構在內源水平上具有小而動態的結構以及複雜的成分,因此分離未知的生理液態/固態凝聚物並以蛋白質組學的方式表征凝聚物蛋白仍然是一項挑戰。
成果簡介
爲了解決這一問題,華中科技大學生命學院劉筆鋒和李一偉教授等合作者聯合提出了一種新策略,旨在通過將蛋白質在細胞中排序爲不同的寡聚態來識別生物分子凝聚物並篩選其候選相分離蛋白質。通過使用滲透壓壓縮輕微調節細胞內蛋白質濃度和分子擁擠度,研究人員成功發現了1518個內源表達水平的凝聚物蛋白質,其中包括538個尚未被報道的凝聚物蛋白質。
該方法有利于快速擴展內源性生物分子凝聚物的數據集,並能篩選出特異性響應的候選相分離蛋白質。這項研究成果在線發表在Nature Chemistry雜志上,題爲“High-throughput and proteome-wide discovery of endogenous biomolecular condensates”,引起了廣泛關注!

圖文導讀
爲了高通量識別生物分子凝聚物,研究者在圖1a中首先使用了蔗糖密度梯度超速離心的方法,將細胞裂解液中的蛋白質按照其密度分離出來,隨後利用定量質譜技術對不同密度梯度分數中的蛋白質進行了檢測和識別。研究者通過這一步驟識別出了具有不同的寡聚蛋白質,作爲生物分子凝聚物的成分,以及候選的相分離蛋白質。在圖1b中,研究者采用了滲透壓壓縮的方法來動態擾動相分離蛋白質的程度。通過使用高滲介質(含有5%聚乙二醇(PEG)300)來減小細胞的體積,研究者實現了細胞濃度的增加和分子擁擠度的提高。這種操作使得相分離蛋白質的聚態發生改變,進一步幫助識別生物分子凝聚物的組分。
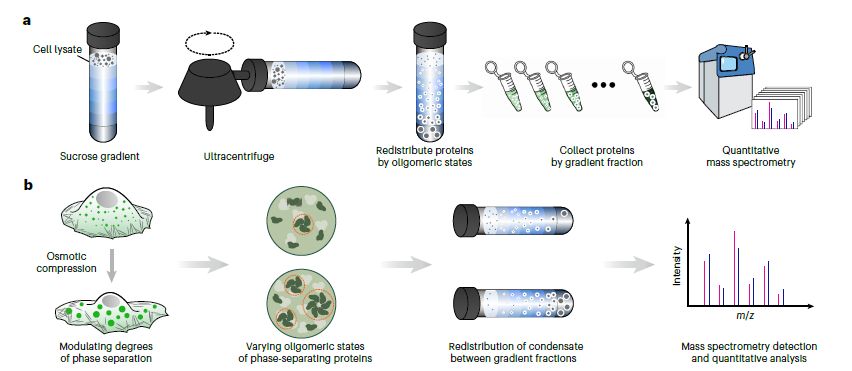
圖1. 生物分子凝聚物高通量識別的示意圖。
在圖2中,研究者進行了高通量鑒定相分離蛋白質的實驗。圖中分爲多個部分,其中a部分展示了實驗的可重複性,通過皮爾遜相關系數顯示了實驗數據之間的良好相關性。b部分顯示,在8,425種檢測到的蛋白質中,有1,050種被確定爲生物分子凝聚物(BMCs)中的蛋白質。其中625種已經在PhaSepDB數據庫中報道爲相分離蛋白質,而剩余的425種被確定爲尚未報道的相分離候選蛋白質。c部分展示了在每個分數中檢測到的新蛋白質和新發現的候選蛋白質的數量。d部分顯示了11種已知無膜細胞器中各個分數中檢測到的蛋白質數量,提示了蛋白質的寡聚態分布。e部分表明,來自不同寡聚態的內源相分離蛋白質包含不同的結構域和屬于不同的家族。總之,這些結果顯示,使用這種高通量方法可以有效地識別和鑒定生物分子凝聚物和相分離蛋白質。
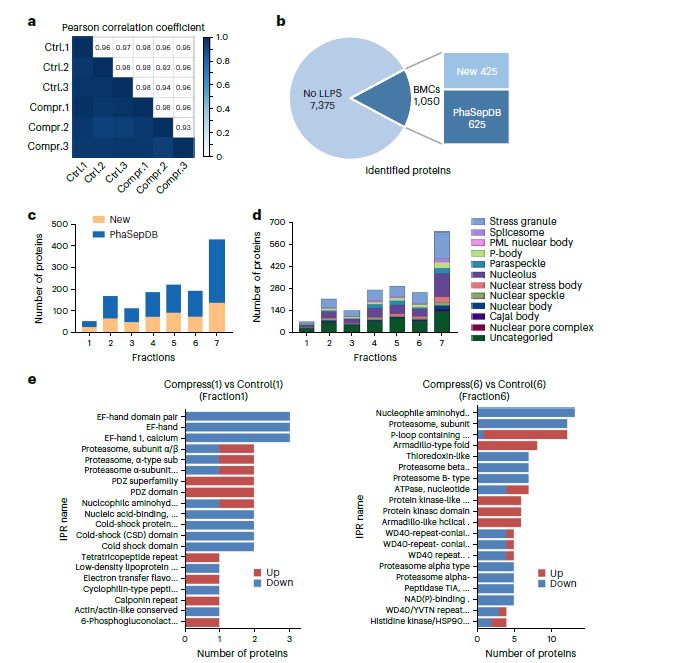
圖3的實驗旨在驗證候選凝聚物蛋白的相分離行爲。其中,在a部分作者通過體積壓縮驗證了內源性表達的凝聚物蛋白。b部分顯示了在體積壓縮下蛋白質的寡聚態分布發生了轉移,其中第六個分數的蛋白質寡聚態發生了顯著變化。c部分顯示,在第六個分數中總共確定了141種蛋白質爲內源性凝聚物蛋白,其中112種已被報道,而29種是新發現的。爲了驗證報道的112種蛋白質,作者選擇了兩種蛋白質進行驗證,PRDX1和YBX1,結果顯示它們在體積壓縮下形成的凝聚物結構更大。同時,熒光免疫染色結果進一步確認了它們的凝聚狀態。
此外,對四種新發現的凝聚物蛋白質(MTDH、ZNF431、MRPL23和TOE1)進行了進一步研究,結果顯示它們在細胞內形成了類似斑點的結構,並且在活細胞成像中觀察到了這些結構的融合和分裂。FRAP實驗進一步驗證了這些蛋白在結構內的動態交換。這些發現爲作者理解細胞內凝聚物蛋白的相分離行爲提供了重要證據,同時也爲凝聚物的功能和機制研究提供了新的視角。

圖3. 通過體積壓縮識別的凝聚物蛋白的驗證。
圖4是驗證其技術能否鑒定與轉化生長因子β(TGF-β)信號通路相關的生物分子凝聚物。爲此,他們對H1975細胞進行了短期(40分鍾)或長期(兩天)的TGF-β處理,並進行了進一步的分析。
圖4a中展示了研究者識別內源性凝聚物蛋白的方法示意圖。b部分展示了在短期TGF-β處理下蛋白寡聚態分布的變化變化情況。c部分展示了在短期TGF-β處理下鑒定的50種凝聚物蛋白。這些蛋白中,92%(46/50)與TGF-β信號通路相關,包括在TGF-β誘導的無膜細胞器中發現的蛋白、調節TGF-β受體/共受體的蛋白、TGF-β下遊調控蛋白和調節TGF-β信號通路上遊的蛋白等。
此外,研究者還驗證了一些已知蛋白(如EMD和PCNA)以及一些新發現的蛋白(如NCEH1、NAMPT、ASNS和LTA4H)在TGF-β處理後的凝聚物形成行爲。通過這些實驗結果,研究者成功地鑒定了TGF-β信號通路中參與的凝聚物蛋白,並且提供了更多有關這些蛋白在細胞內作用機制的信息。

圖4. 對TGF-β短期處理的凝聚物蛋白的識別。
在圖5中他們觀察到不同幹擾條件下識別的蛋白質模式有所不同。通過對蛋白質的功能進行分類,研究人員發現,這些蛋白質涉及不同的生物過程。在壓縮條件下識別的凝聚物蛋白主要與翻譯和轉錄相關(見圖5b),而在短期TGF-β刺激條件下觀察到的蛋白則與Wnt平面細胞極性(PCP)信號和經典信號的負調節有關(見圖5c)。 另一方面,長期TGF-β刺激引發的上皮-間質轉化(EMT)導致凝聚物蛋白模式的擴展和變化,涉及到更多的生物過程,如點粘附、RNA結合、緊密連接和Hippo信號傳導(見圖5d)。通過富集分析,他們發現這些凝聚物蛋白可能參與調節其他重要的生物過程,如成骨細胞分化、腫瘤壞死因子信號、白細胞介素17信號、肥厚型心肌病和心肌收縮。這些發現爲作者提供了深入了解相分離蛋白在細胞內生物學過程中的作用的見解,並爲進一步研究這些蛋白的功能和調節提供了重要線索。

圖5. 內源表達相分離蛋白的蛋白組學分析。
總結展望
本文展示了一種創新的高通量策略,可用于在蛋白質組水平上識別內源性生物分子凝聚物,並篩選參與相分離的蛋白質。通過結合體積壓縮和TGF-β信號轉導等生物學過程,研究人員揭示了大量內源性蛋白質對相分離的響應,並發現了一系列之前從未報道過的潛在凝聚物形成蛋白質。
此外,研究人員的方法還揭示了細胞體積變化對蛋白質相分離狀態的影響,進一步證明了分子擁擠在細胞內物理/機械調控中的重要性。最重要的是,該研究爲量化和內源性蛋白質組學提供了一種全新的方法,這將極大地促進對生物分子凝聚物和相分離的深入理解,從而推動基礎生物學和轉化醫學領域的進展。
文獻信息
Li, P., Chen, P., Qi, F. et al. High-throughput and proteome-wide discovery of endogenous biomolecular condensates. Nat. Chem. (2024).





幹啥用的?