人類身高差異是成百上千個基因及其與環境相互作用的累積結果。兒童時期的骨骼生長受長骨末端附近的骨骺生長板的支配,受生長板上局部表達的許多不同基因和許多內分泌信號的調節,而它們又受到營養和其它環境因素的影響。

因此,影響生長板的遺傳疾病(比如軟骨發育不全)、內分泌系統紊亂(比如生長激素缺乏)、影響營養攝入的醫療條件(比如乳糜瀉)和慢性營養不良,都可能導致兒童骨骼生長減少和身材矮小。人類身高還與世界人口的教育水平、經濟生産力和預期壽命密切相關。不幸的是,兒童生長遲緩仍然普遍存在于低收入或中等收入國家,並且仍然是一個主要的全球公共衛生挑戰。
腸道菌群是生活在腸道內並與宿主互惠共生的微生物群落,包括細菌、真菌和病毒等。腸道菌群影響著人類健康的許多方面,包括營養攝入、代謝、免疫反應和神經行爲發育。在過去的十年中,令人興奮的研究表明,腸道菌群在骨骼生長和身體生長發育的激素和營養調節中也起著重要作用。
兒童骨骼生長的調節
生長激素-胰島素樣生長因子1軸(GH/IGF-1軸)與骨骼生長兒童骨骼生長受到不同內分泌信號之間的複雜相互作用的調控,包括生長激素(GH)、胰島素樣生長因子1(IGF-1)、甲狀腺激素、糖皮質激素和性類固醇激素(比如雌激素)。GH/IGF-1軸是迄今爲止骨骼生長最重要的內分泌調節因子,它與腸道菌群之間也存在相互作用。
下丘腦産生的生長激素釋放激素會刺激腦垂體前葉分泌生長激素。生長激素隨後作爲內分泌因子在循環中傳播,作用于表達生長激素受體的目標組織,比如肝髒、腸道和生長板。雖然生長激素對其目標組織也有直接的生長促進作用,但生長激素的主要功能是激活IGF-1的産生,而IGF-1本身也是一種有力的生長刺激因子。
當生長激素誘導的IGF-1在肝髒産生時,肝髒IGF-1與IGF結合蛋白IGFBP3結合,並作爲內分泌因子作用于IGF-1受體,刺激全身許多不同組織的生長。當非肝髒IGF-1在局部産生時,比如在生長板中,IGF-1會作爲自分泌或旁分泌因子,刺激軟骨細胞的幹細胞募集、增殖和肥大性分化,所有這些都是驅動骨延長所必需的。此外,生長激素誘導的局部IGF-1産生也支持小腸上皮幹細胞增殖和營養物質吸收。
垂體腺瘤會導致全身生長激素和IGF-1水平升高,從而導致巨人症和肢端肥大症;相反,生長激素缺乏會導致IGF-1水平下降和身材矮小。因此GH/IGF-1軸對身體生長至關重要。
與許多其它內分泌系統類似,循環IGF-1水平和垂體中生長激素的分泌之間存在負反饋循環。 因此,在生長激素不敏感(也稱爲Laron綜合征)的患者中,由于生長激素受體的功能缺失突變,IGF-1的産生減少,導致線性生長不良,但由于缺乏反饋抑制,生長激素的水平升高。
垂體中生長激素的産生也受到能量代謝和食欲相關的一些激素的調節。下丘腦和胃腸道産生的生長抑素,會抑制生長激素的産生。相反,胃分泌的胃饑餓素和脂肪組織産生的瘦素,都會刺激生長激素的分泌。
GH/IGF-1軸的營養調節營養在調節骨骼生長的GH/IGF-1軸中起著重要作用。在慢性營養不良期間,肝髒和生長板中的生長激素受體表達都會下調,從而限制循環生長激素誘導肝髒和外周IGF-1産生的能力,導致類似Laron綜合征的生長激素不敏感狀態。
因此,營養不良兒童的全身IGF-1減少,但生長激素水平升高,除了由于饑餓誘導的胃饑餓素水平升高以外,這主要是由于缺乏IGF-1的負反饋。IGF-1信號傳導減少也可以直接限制生長板中軟骨細胞的增殖和肥大性分化。此外,營養不良期間IGF-1的減少和必需氨基酸的缺乏也可以抑制mTOR信號靶點,從而負向調節細胞分裂和存活。
生長板衰老和追趕生長骨骼縱向生長的速度在生命的前1000天是最快的,當我們接近最後的成年身高時逐漸減慢。這種生長減速與生長板功能的逐漸下降有關,也稱爲生長板衰老。重要的是,生長板衰老的特征是生長板中的軟骨幹細胞逐漸耗盡,軟骨細胞增殖和肥大逐漸減少。
盡管生長板衰老通常與年齡有關,但它似乎不是由年齡本身所驅動的,而是取決于生長潛力被“消耗”了多少。換句話說,生長板中的軟骨細胞似乎只有有限的生長潛力,隨著骨骼生長的增加,這種潛力會逐漸耗盡,導致生長速度逐漸下降,並伴隨衰老相關變化。
事實證明,生長抑制條件,比如營養不良,可以減緩生長板衰老,一旦營養狀況改善,骨骼生長不僅可以恢複,而且可以暫時加速,比正常年齡更快,這是一種被稱爲“追趕生長”(catch-up growth)的臨床現象。
腸道菌群和骨骼生長
腸道菌群對骨骼生長的影響2016年,一些研究強調了腸道菌群在骨骼生長中的重要性。比如,與擁有正常菌群的小鼠相比,無菌小鼠的生長發育和骨骼縱向生長都有所下降。無菌小鼠的這種生長缺陷似乎是由腸道菌群的缺乏所引起的,因爲無菌小鼠腸道重新定植植物乳杆菌能夠在很大程度上彌補它們的生長缺陷。另一項類似的研究發現,無菌小鼠重新定植腸道菌群可以改善骨骼形成和長骨長度。
總之,這兩項研究令人信服的表明,腸道菌群的存在對正常的骨骼生長是有益的,也許是必不可少的。
 腸道菌群對IGF-1的可能影響
腸道菌群對IGF-1的可能影響腸道菌群支持骨骼生長的分子機制尚不清楚。這可能與GH/IGF-1軸有關,因爲無菌小鼠的循環IGF-1和IGFBP3水平下調,這可以通過重新定植微生物而逆轉。
一方面,腸道菌群可能特異性地調節宿主GH/IGF-1軸,例如,肝髒IGF -1的産生可能受到腸道微生物釋放的某些分子或代謝物的刺激。另一方面,腸道菌群通常有助于宏量營養素的消化,而在無菌小鼠中,這一功能變得不那麽有效,導致輕度營養不良狀態。在這種情況下,IGF-1和IGFBP3下降而生長激素沒有變化,這可能代表生長激素不敏感,這是營養不良引起的諸多激素變化之一。這兩個方面並不相互排斥,而可能是相輔相成的。
有研究人員將無菌小鼠的循環IGF-1水平恢複到擁有正常菌群的小鼠相似的水平,然後看看是否足以完全恢複骨骼生長,以測試腸道菌群是否真的通過GH/IGF-1軸來調節骨骼生長。注射重組IGF-1確實能夠促進無菌小鼠的骨骼生長,但是在擁有正常菌群的小鼠中沒有統計學意義,因此,無菌小鼠的生長缺陷確實是由IGF-1的減少所驅動的。
腸道菌群對IGF-1的可能調控機制如果腸道菌群確實能夠特異性調節GH/IGF-1軸,那麽微生物刺激IGF-1分泌的分子信號是什麽呢?
一種可能是短鏈脂肪酸,它是腸道細菌發酵膳食纖維過程中産生的主要代謝物。通過使用廣譜抗生素或萬古黴素清除小鼠的腸道微生物,會導致血清IGF-1水平降低,而這可以通過補充短鏈脂肪酸得以逆轉。
如果短鏈脂肪酸能夠刺激GH/IGF-1軸,那麽,哪些信號通路能夠實現這一點呢?參與IGF-1産生的短鏈脂肪酸受體可能是G蛋白偶聯受體GPR41和GPR43,其在骨骼中的表達可以通過糞菌移植來誘導。胃饑餓素也可能允許短鏈脂肪酸誘導的GH/IGF-1軸的調節,因爲它可以刺激腦垂體中生長激素的分泌。
腸道菌群刺激IGF-1的信號甚至可能不是代謝物。事實上,最近的一項研究表明,從植物乳杆菌中分離出來的細菌細胞壁足以刺激小鼠的IGF-1和骨骼生長,因此,宿主對細菌或細菌成分的感知可能就能夠誘導促進生長的代謝和激素信號。
這似乎是由腸上皮細胞中表達的一種先天性免疫受體核苷酸結合寡聚結構域蛋白2 (NOD2)所驅動的,因爲細菌細胞壁無法誘導NOD2缺失小鼠的IGF-1並改善其骨骼生長。同樣,NOD2激活配體,比如胞壁酸二肽或米伐木肽(人工合成的NOD2激活劑,一種胞壁酸二肽類似物),就足以誘導IGF-1和骨骼生長,因此,NOD2激動劑可能是改善兒童生長遲緩的一類新的治療藥物。
炎症細胞因子和其它可能機制腸道菌群是否可以通過其它分子機制來支持骨骼生長呢?一種潛在的機制可能是通過調節炎症細胞因子對骨骼生長的影響。衆所周知,慢性炎症性疾病,比如炎症性腸病、克羅恩病、潰瘍性結腸炎和青少年特發性關節炎,會對兒童的骨骼生長産生負面影響。這種生長發育障礙部分是因爲這些疾病相關的營養不良以及糖皮質激素治療的不良副作用。
然而,生長抑制的另一個主要原因來自炎症性疾病中經常升高的細胞因子的局部作用。在系統水平上,促炎細胞因子可以通過抑制IGF-1來抑制骨骼生長。例如,在過表達促炎的IL - 6的小鼠中,身體生長發育明顯受到抑制,IGF-1和IGFBP3水平下降,但生長激素水平正常。在局部水平上,促炎的腫瘤壞死因子α、白細胞介素- 1β和IL - 6均能抑制生長板中軟骨細胞的增殖和肥大,同時促進細胞凋亡。
腸道菌群也可影響促炎細胞因子的循環水平。血清IL -1β和IL - 6水平與腸道菌群中某些細菌菌株的存在相關。從機制上講,腸道菌群産生的短鏈脂肪酸丁酸可以通過GRP41和GRP43抑制內皮細胞和軟骨細胞中脂多糖、TNFα和白細胞介素引發的炎症反應,因此,健康的腸道菌群可以通過減少炎症來刺激骨骼生長。
腸道菌群應該成爲生長遲緩的治療靶點
腸道菌群的健康成熟新生兒腸道菌群的建立受到多種因素的影響,包括出生方式、母體菌群、母乳餵養等環境因素。在嬰兒早期,腸道菌群的生物多樣性很有限。例如,在母乳餵養的嬰兒中,他們的腸道菌群大多來源于母乳。在生命的第一年,嬰兒腸道菌群會經曆巨大的變化,主要是由營養供應和飲食複雜性的增加所決定的。在2-3歲時,逐漸建立起穩定且多樣化的腸道菌群。
腸道菌群的這種演替和成熟在人體健康各個方面的正常發育和維持中起著至關重要的作用。在一項對孟加拉國健康嬰兒的研究中,確定了24個可區分年齡的細菌分類群,它們在生命最初2年的豐度變化可用于定義正常腸道菌群成熟的過程,這與兒童的實際年齡和健康生長表型顯著相關。最近的一項研究表明,腸道菌群中的細菌分類可能不一定能預測未來的生長軌迹,相反,腸道菌群的功能宏基因組特征是線性生長、體重增長和生長速度的更好指標。
兒童生長遲緩的惡性循環腸道菌群持續不成熟與兒童營養不良有關,這在嚴重急性營養不良兒童中尤爲嚴重。在嚴重急性營養不良兒童中,營養幹預只能部分改善其腸道菌群成熟度,對改善生長發育完全無效。
反過來,將來自營養不良兒童的腸道菌群移植到無菌小鼠和豬體內,足以誘導骨骼生長和生長發育遲緩。由于腸道菌群也可能影響營養攝入,因此,兒童生長遲緩可能存在惡性循環,營養不良引起的腸道菌群失調本身也會導致營養不良和兒童生長遲緩。
這種惡性循環也可能是代際的,因爲母體菌群會強烈影響胎兒早期生長、出生體重和嬰兒腸道菌群的成熟。此外,一些證據表明,當營養不良對腸道菌群的負面影響跨越幾代人時,可能會變得更難糾正。因此,在解決兒童生長遲緩的過程中,應考慮將修複腸道菌群作爲預防和解決兒童生長遲緩的一部分。
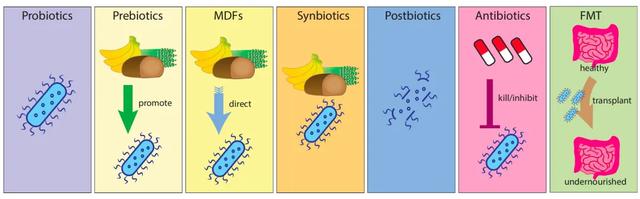 修複腸道菌群的治療策略
修複腸道菌群的治療策略基于腸道菌群的治療策略在動物模型中顯示出極大的潛力。例如,將來自營養不良的兒童的糞便菌群移植到年輕無菌小鼠中,可導致無菌小鼠的生長發育受損。如果讓它們與健康小鼠共同居住在一起,健康小鼠的腸道微生物會入侵到這些小鼠體內,阻止它們的生長發育受損。給它們補充兩個入侵物種(活潑瘤胃球菌和共生梭菌)也能改善生長和代謝異常。
同樣,一樣類似的研究發現,補充某種植物乳杆菌菌株(或者從植物乳杆菌分離的細菌細胞壁)也可以改善營養不良小鼠的生長發育,這爲在臨床試驗中測試不同的方法提供了強有力的依據。
臨床上的一些成功案例包括:
1、益生菌和合生元治療
此前,在馬拉維和烏幹達進行的兩項大型臨床試驗顯示,益生菌幹預後,嚴重急性營養不良兒童的營養恢複情況令人失望。然而,最近發表的一項名爲SYNERGIE(緊急緩解腸道不穩定和腸病的合成元)的單盲隨機臨床試驗中,益生菌顯著改善了孟加拉國2-6月齡的嚴重急性營養不良嬰兒的體重增加。
嬰兒雙歧杆菌通常存在于母乳餵養的健康嬰兒的腸道菌群中,但在嚴重急性營養不良的嬰兒中卻很少,研究人員單獨使用嬰兒雙歧杆菌或與人乳低聚糖乳糖-N-新四糖聯合使用,每天一次,持續一個月,可以改善他們的生長發育,增加體重和上臀圍。
2、促進腸道關鍵細菌生長的食物配方
益生元是食物中可促進腸道有益微生物生長的成分,與益生元一樣,一些特殊設計的食物配方可以塑造腸道菌群的組成,具有促進關鍵腸道微生物生長和提高腸道菌群成熟度的能力。
2019年的一項初步試驗中,研究人員給孟加拉國12-18月齡患有嚴重急性營養不良的兒童接受一種可促進腸道關鍵細菌生長的食物配方,爲期4周,並進行了2周的隨訪。結果發現,它可以顯著改善體重增加,並增加血漿中IGF-1和IGFBP3的水平,顯著提高了受試者的生長,骨形成,神經發育和免疫功能水平。
在隨後的一項試驗中,研究人員進行了通過更長時間的幹預,持續3個月,結果發現,患者身高和體重的周變化均有所改善。這種效果似乎是由腸道菌群的改善所調節的,因爲患者中參與正常腸道菌群成熟的細菌分類群顯著增加。這些細菌類群的富集也與這些患者的體重增加呈正相關。
3、抗生素的雙刃劍效應
世界衛生組織建議使用短期療程的抗生素,比如阿莫西林,用于無並發症的嚴重急性營養不良的門診治療。然而,抗生素也可能不分青紅皂白地針對有害菌和有益菌,從而擾亂腸道微生物生態系統。先前的研究表明,即使短期使用抗生素對早産兒的腸道菌群也有潛在的有害和長期影響。
在一項大型臨床試驗中,尼日利亞嚴重急性營養不良兒童接受阿莫西林治療7天,1個月後患兒的生長發育有所改善,但在1年後基本消失。
然而,在最近發表的關于這一臨床試驗的二次分析中,研究人員將重點放在抗生素耐藥性和腸道菌群上,結果發現盡管阿莫西林會短暫地增加抗生素耐藥性基因並降低腸道菌群的多樣性,但這些變化在3周內基本消退。令人驚訝的是,初始治療2年後,阿莫西林治療兒童的腸道菌群多樣性和豐富度相對于安慰劑對照組兒童都有所增加,因此,某些意想不到的長期益處可能超過抗生素耐藥性的短期風險。
不過,使用抗生素還是得謹慎,後續正在進行的代謝和人體測量學分析將有助于闡明抗生素治療是否對骨骼生長有任何長期益處。
總結
兒童生長遲緩和消瘦,或營養不良相關的線性生長和體重增長下降,仍然是全球公共衛生的一項重大挑戰。雖然目前的許多治療和飲食幹預措施大大降低了營養不良造成的兒童死亡,但在改善兒童生長遲緩方面仍然存在很大的不足。
兒童骨骼縱向生長受不同的遺傳、營養和其它環境因素的支配,這些因素系統性地作用于內分泌系統和生長板。孩子長高就依賴于骨骼縱向生長,而生長板是關鍵。最近的研究表明,生長板的營養和激素調節之間複雜的相互作用可能涉及腸道菌群,因此,腸道菌群在解決兒童營養不良問題中非常重要,這也可能正是解決兒童營養不良和生長發育遲緩的關鍵。除了改善營養狀況外,通過引入刺激生長發育的細菌菌株或通過促進腸道菌群成熟來緩解腸道菌群失調,應被視爲治療兒童生長發育遲緩的重要部分。
圖片均來自網絡
參考資料:
Lui, J. C. (2024). Gut microbiota in regulation of childhood bone growth. Experimental Physiology, 109, 662-671
